
Przemiany Gazu Doskonałego
Szczególne przemiany gazu doskonałego wynikają z równania Clapeyrona, znanego takaże jako równanie stanu gazu:
1. Wstęp do Przemian Gazowych
Gaz doskonały opisuje równanie Clapeyrona:
- p: ciśnienie (Pa),
- V: objętość (m³),
- T: temperatura (K),
- n: liczba moli gazu,
- R: stała gazowa, \( R = 8.31 \, \text{J}/(\text{mol} \cdot \text{K}) \).
Równanie to jest podstawą do wyprowadzania wzorów opisujących szczególne przemiany.
2. Przemiana Izotermiczna
Przemiana izotermiczna to proces, w którym gaz zmienia swoje ciśnienie i objętość, podczas gdy temperatura pozostaje stała (\( T = \text{const} \)). Energia wewnętrzna gazu nie zmienia się, a zależność między ciśnieniem i objętością wyraża równanie:
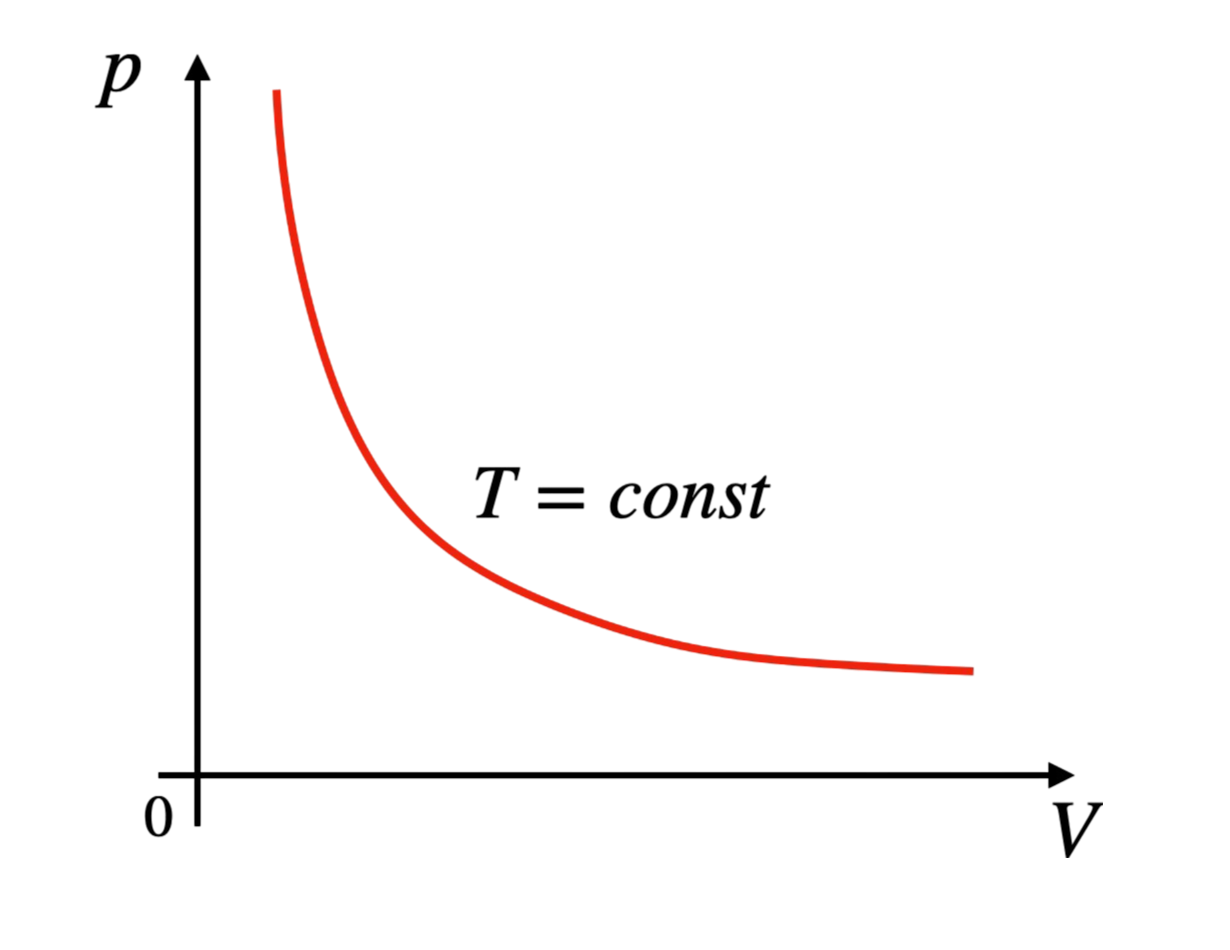
3. Przemiana Izobaryczna
Przemiana izobaryczna to proces, w którym ciśnienie gazu pozostaje stałe (\( p = \text{const} \)), a objętość zmienia się proporcjonalnie do temperatury. Równanie przemiany izobarycznej to:
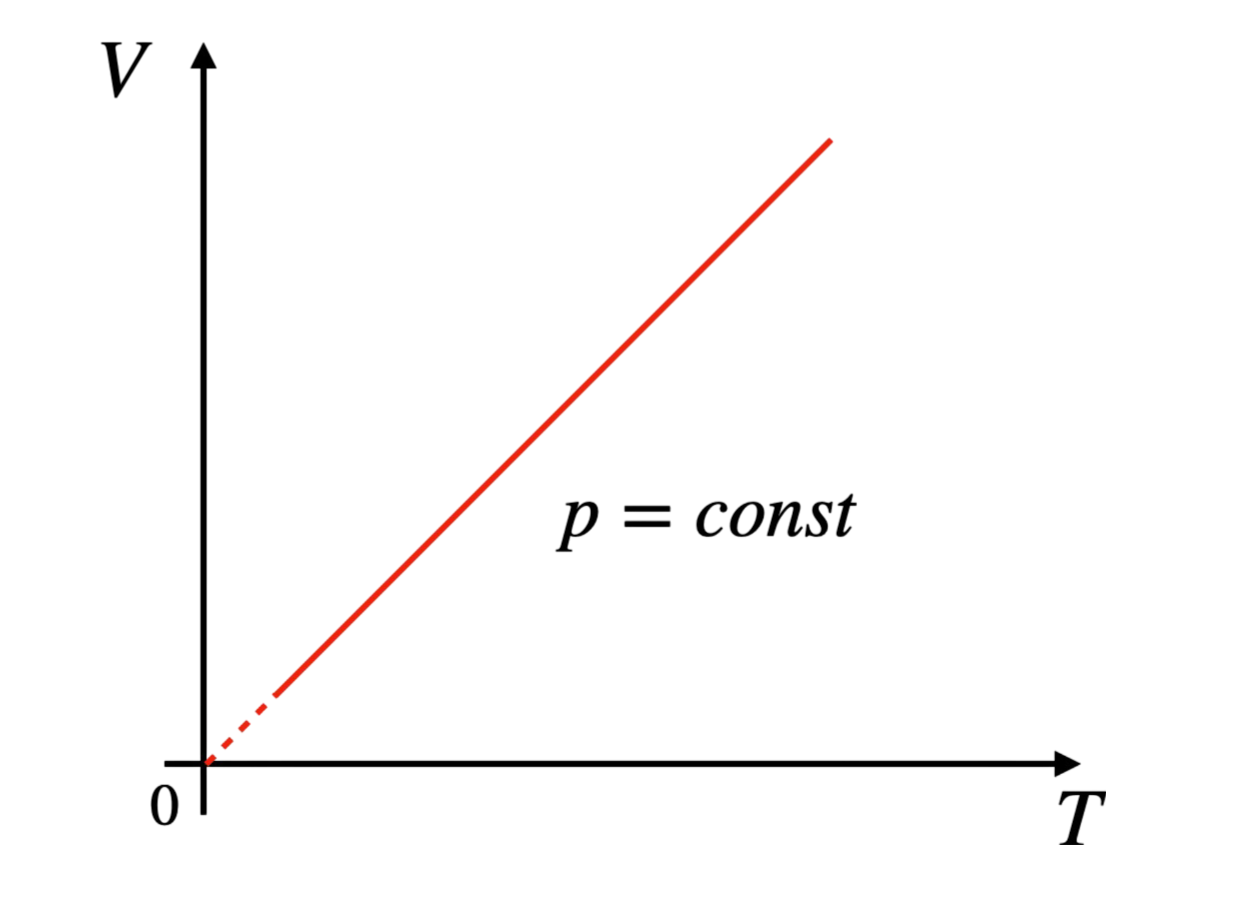
4. Przemiana Izochoryczna
Przemiana izochoryczna to proces, w którym objętość gazu pozostaje stała (\( V = \text{const} \)), a ciśnienie zmienia się proporcjonalnie do temperatury. Równanie przemiany izochorycznej to:

5. Przemiana Adiabatyczna
Wzór dla przemiany adiabatycznej:
6. Przykładowe Zadanie: Połączenie Dwóch Zbiorników
Treść zadania: Dwa zbiorniki zawierają gaz doskonały:
- Zbiornik 1: \( p_1 = 100 \, \text{kPa} \), \( V_1 = 2 \, \text{m}^3 \).
- Zbiornik 2: \( p_2 = 200 \, \text{kPa} \), \( V_2 = 1 \, \text{m}^3 \).
Po połączeniu obu zbiorników ciśnienie wyrównuje się. Oblicz ciśnienie końcowe, zakładając stałą temperaturę.
