Spis treści
Atom jest fundamentalną jednostką materii, złożoną z jądra oraz otaczającej go chmury elektronów. W artykule przybliżono strukturę atomu, podkreślając znaczenie protonów, neutronów i elektronów. Omówiono także kluczowe właściwości, takie jak masa, ładunek elektryczny i stabilność. Dodatkowo, poruszono zagadnienia dotyczące izotopów i ich radioaktywności, szczególnie zwracając uwagę na różnice wynikające z liczby neutronów.
Co to jest atom – podstawowy składnik materii
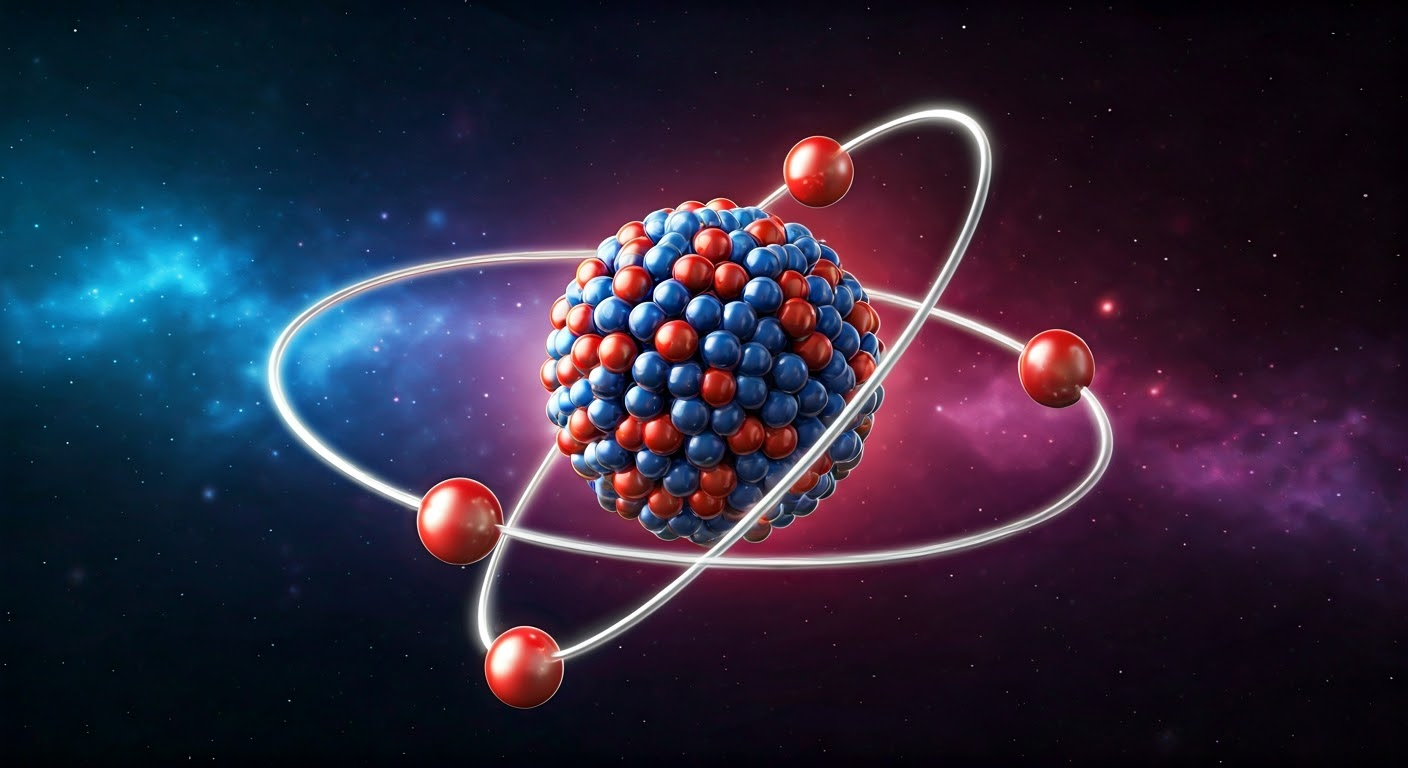
Atom to najmniejszy składnik materii, który zachowuje jej chemiczne cechy. Składa się z jądra, w którym znajdują się protony i neutrony, oraz otaczającej je chmury elektronowej. Elektrony poruszają się po określonych orbitach wokół jądra. Kiedy liczba protonów jest równa liczbie elektronów, atom pozostaje elektrycznie neutralny.
Dzięki wiązaniom chemicznym, atomy mogą łączyć się w cząsteczki, tworząc bardziej złożone struktury, takie jak związki chemiczne. Każdy pierwiastek ma unikalną liczbę protonów w jądrze, określaną jako liczba atomowa. Na przykład wodór posiada jeden proton, podczas gdy tlen ma ich osiem.
Podstawowe cechy atomów, takie jak masa i stabilność, wynikają z ilości protonów i neutronów w jądrze oraz rozmieszczenia elektronów. Główna część masy atomowej koncentruje się w jądrze, ponieważ protony i neutrony są znacznie masywniejsze od elektronów. Zrozumienie struktury i właściwości atomów jest fundamentalne w chemii i fizyce, gdyż stanowi podstawę analizy i tworzenia substancji.
Budowa atomu – jądro i chmura elektronowa
Atom składa się z dwóch zasadniczych elementów: jądra oraz chmury elektronowej. Centralna część atomu, czyli jądro, ma dodatni ładunek i cechuje się wysoką gęstością, osiągając rozmiar w przybliżeniu 1 femtometra. W jego wnętrzu mieszczą się protony i neutrony, które odpowiadają za większość masy tego układu.
Otoczenie jądra stanowi chmura elektronowa, w której elektrony poruszają się po orbitach nazwanych powłokami elektronowymi. Te ujemnie naładowane cząstki są przyciągane przez dodatnie protony w jądrze, co sprawia, że pozostają blisko niego.
Budowa atomu, złożona z jądra i chmury elektronowej, jest kluczowa dla zrozumienia właściwości chemicznych pierwiastków. Sposób rozmieszczenia elektronów determinuje zdolność atomu do tworzenia wiązań chemicznych.
Właściwości atomu – masa, ładunek i stabilność
Większość masy atomu jest skoncentrowana w jądrze, zbudowanym z protonów i neutronów. Waga atomów mieści się w zakresie od 10−26 do 10−25 kg. Nukleony, czyli protony i neutrony, są znacznie cięższe od elektronów, co sprawia, że jądro jest głównym źródłem masy atomu.
Atom pozostaje elektrycznie neutralny, gdy liczba protonów z ładunkiem dodatnim jest równa liczbie elektronów o ładunku ujemnym. Taka równowaga zapewnia neutralność elektryczną, co jest charakterystyczne dla większości stabilnych atomów.
Stabilność atomu zależy od struktury jądra, zwłaszcza od proporcji protonów do neutronów. Nadmiar neutronów w stosunku do protonów może prowadzić do niestabilności i w rezultacie do rozpadu radioaktywnego. Chemiczna stabilność atomów jest istotna, gdyż wpływa na ich zdolność do tworzenia trwałych wiązań chemicznych.
Skład atomu – jądro, protony, neutrony i elektrony
Atom składa się z centralnego jądra oraz otaczającej go chmury elektronowej. W środku znajduje się jądro, które zbudowane jest z protonów i neutronów, będących subatomowymi cząstkami. Protony posiadają ładunek dodatni, natomiast neutrony są elektrycznie obojętne. Wspólnie stanowią one główną część masy atomowej, ponieważ ich masa jest znacznie większa od masy elektronów. Mimo niewielkich rozmiarów, jądro jest odpowiedzialne za większość masy atomu.
Elektrony, które są naładowane ujemnie, poruszają się wokół jądra po różnych orbitach, tworząc chmurę elektronową. Ich rozmieszczenie wpływa na chemiczne właściwości atomu oraz jego zdolność do tworzenia wiązań. Ładunek dodatni protonów przyciąga elektrony, co zapewnia stabilność całej struktury atomu.
Zrozumienie budowy atomu, a więc jego jądra i chmury elektronowej, jest kluczowe dla poznania jego fizycznych i chemicznych właściwości. Jądro, złożone z protonów i neutronów, wpływa na masę i stabilność atomu, podczas gdy elektrony determinują jego zachowanie chemiczne.
Jądro atomowe – rozmiar i skład
Jądro atomowe ma rozmiar około 1 femtometra i składa się z protonów oraz neutronów. Protony są naładowane dodatnio, podczas gdy neutrony nie mają ładunku elektrycznego. Te subatomowe cząstki tworzą większość masy atomu, ponieważ są znacznie cięższe od elektronów. Nukleony, czyli protony i neutrony, odgrywają kluczową rolę w utrzymaniu stabilności jądra. Ich wzajemna równowaga wpływa na trwałość atomu. Zbyt wiele neutronów może prowadzić do radioaktywnego rozpadu. Jądro, będące centrum atomu, decyduje o jego masie i oddziałuje na właściwości chemiczne.
Elektrony i powłoka elektronowa
Elektrony krążą wokół jądra atomu na różnych powłokach. Sposób ich rozmieszczenia determinuje zarówno właściwości chemiczne, jak i magnetyczne atomu. Powłoki te są zorganizowane na rozmaitych poziomach energetycznych, co ma wpływ na konfigurację elektronową. Konfiguracja ta ilustruje rozmieszczenie elektronów i jest istotna dla zrozumienia reaktywności chemicznej oraz zdolności atomu do tworzenia wiązań z innymi pierwiastkami.
Na przykład atomy, które mają pełne zewnętrzne powłoki, zwykle charakteryzują się mniejszą reaktywnością, co można zaobserwować u gazów szlachetnych. Elektrony na zewnętrznej powłoce, zwane walencyjnymi, odgrywają kluczową rolę w tworzeniu wiązań chemicznych, takich jak kowalencyjne lub jonowe.
Izotopy i radioaktywność – różnice w liczbie neutronów
Izotopy to atomy tego samego pierwiastka, które różnią się liczbą neutronów w swoich jądrach. Choć mają taką samą liczbę protonów, przez co są chemicznie identyczne, różni je masa atomowa. Przykładowo, wodór posiada trzy izotopy:
- prot,
- deuter,
- tryt.
Różnią się one między sobą liczbą neutronów.
Radioaktywność izotopów jest rezultatem niestabilności niektórych jąder atomowych. Te niestabilne wersje, nazywane promieniotwórczymi, ulegają rozpadowi, emitując promieniowanie alfa, beta lub gamma. Podczas rozpadu zmienia się liczba neutronów i protonów, co może prowadzić do przekształcenia izotopu w inny pierwiastek.
Stabilność jądra jest uzależniona od liczby neutronów. Izotopy z nadmierną ilością neutronów często cechują się niestabilnością i są radioaktywne. Rozpad radioaktywny odgrywa istotną rolę w nauce, medycynie oraz przemyśle. Izotopy znajdują zastosowanie m.in. w:
- datowaniu radiometrycznym,
- diagnostyce medycznej.
Izotopy – definicja i znaczenie
Izotopy to odmienne formy atomów tego samego pierwiastka, które różnią się liczbą neutronów w jądrze. Choć wszystkie mają identyczną liczbę protonów, a zatem są chemicznie takie same, różnią się masą atomową, co wpływa na ich właściwości fizyczne.
Te różnorodne formy atomów znajdują szerokie zastosowanie w różnych dziedzinach:
- w naukach przyrodniczych izotopy są niezastąpione w datowaniu radiometrycznym, co umożliwia określenie wieku starożytnych artefaktów,
- w medycynie odgrywają kluczową rolę w diagnostyce obrazowej, pozwalając na dokładne badanie wnętrza organizmu bez konieczności przeprowadzania inwazyjnych procedur.
Izotopy mogą być zarówno stabilne, jak i niestabilne, w zależności od liczby neutronów. Ta różnorodność czyni je niezwykle użytecznymi w badaniach naukowych oraz zastosowaniach klinicznych.