Spis treści
Fizyka atomowa to kluczowy obszar nauki, umożliwiający zrozumienie budowy i działania materii. Znajdziesz tutaj informacje o podstawach atomu, jego strukturze oraz roli w chemii i fizyce. Przedstawiono także przegląd rozwoju modeli atomowych, począwszy od teorii Daltona, aż po koncepcje Schrödingera. Ponadto, tekst omawia praktyczne zastosowania technologii jądrowej, podkreślając znaczenie atomu we współczesnej nauce i technologii.
Co to jest atom i jego znaczenie w chemii
Atom jest fundamentalnym elementem materii oraz najmniejszą częścią każdego pierwiastka chemicznego. Zbudowany jest z jądra, w którym znajdują się protony i neutrony, oraz elektronów krążących wokół niego. Utrzymuje neutralność elektryczną, gdy liczba protonów, które mają dodatni ładunek, jest równa liczbie elektronów o ładunku ujemnym.
W dziedzinie chemii atom odgrywa kluczową rolę. Jego budowa oraz cechy determinują zachowanie pierwiastków i ich związków chemicznych. Liczba protonów w jądrze, zwana liczbą atomową, definiuje chemiczną tożsamość pierwiastka i wpływa na jego charakterystykę.
Teoria atomistyczna stanowi podstawę współczesnej chemii, opisując strukturę atomów oraz ich zachowanie. Pozwala przewidywać reakcje chemiczne, rozumieć procesy wiązania, a także opracowywać nowe materiały. Dzięki badaniom nad atomami chemicy są w stanie projektować reakcje i rozwijać technologie w dziedzinach takich jak:
- farmacja,
- inżynieria materiałowa,
- energia.
Atom jako najmniejsza jednostka pierwiastka chemicznego
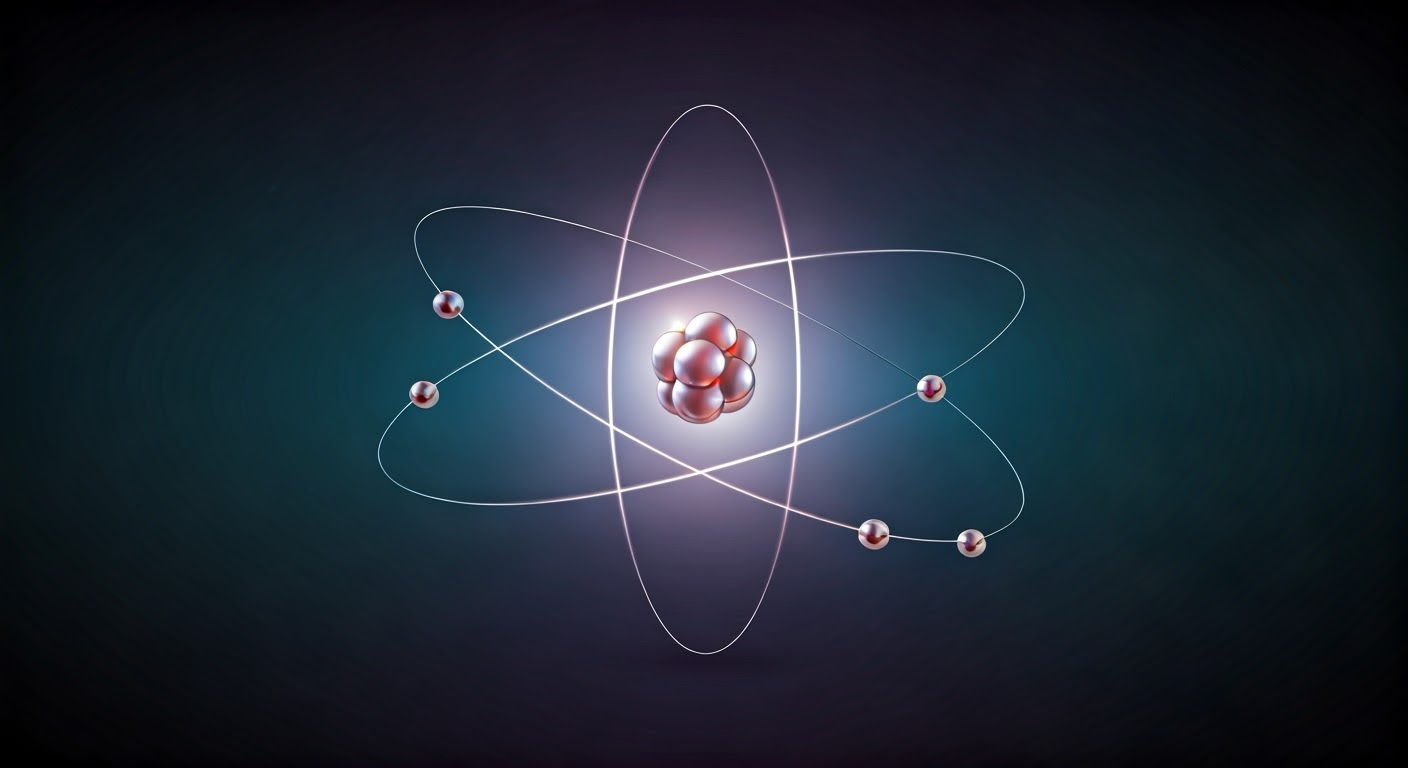
Atom stanowi najmniejszą jednostkę pierwiastka chemicznego, której nie da się podzielić bez utraty jego unikalnych właściwości. Składa się z trzech podstawowych cząstek: protonów, neutronów oraz elektronów. W centrum atomu znajduje się jądro, zbudowane z protonów i neutronów, będące głównym źródłem jego masy. Elektrony z kolei krążą wokół tego jądra, poruszając się po określonych orbitach energetycznych. Podczas gdy protony mają dodatni ładunek, neutrony są neutralne, a obie te cząstki określa się mianem nukleonów. Elektrony, posiadające ujemny ładunek, tworzą wokół jądra tzw. chmurę elektronową.
Zrozumienie budowy atomu jest niezwykle istotne w dziedzinie chemii. Tożsamość chemiczna pierwiastka jest określana przez liczbę protonów w jądrze, znaną jako liczba atomowa. To kluczowe pojęcie umożliwia badaczom zarówno przewidywanie, jak i wyjaśnianie zachowań pierwiastków oraz ich reakcji chemicznych. Atom odgrywa fundamentalną rolę w naukach ścisłych i technologii, stając się podstawą do tworzenia nowych materiałów i rozwoju innowacyjnych technologii.
Znaczenie atomu w zrozumieniu świata
Atom odgrywa kluczową rolę w zrozumieniu otaczającego nas świata, ponieważ stanowi podstawowy budulec materii. Dzięki niemu możemy wyjaśnić właściwości chemiczne różnych substancji oraz mechanizmy reakcji chemicznych. To właśnie atomy umożliwiają nam zrozumienie, jak pierwiastki wchodzą ze sobą w interakcje, co jest niezbędne dla nauk przyrodniczych.
Znajomość budowy atomu pozwala naukowcom przewidywać zachowania chemiczne oraz tworzyć nowe związki, co prowadzi do postępów w takich dziedzinach jak:
- farmacja,
- inżynieria materiałowa,
- energetyka.
Jako podstawowa jednostka pierwiastka chemicznego, atom pozwala zgłębiać zasady funkcjonowania materii na poziomie mikroskopowym.
Budowa atomu – składniki i ich właściwości
Atom składa się z trzech podstawowych cząstek: protonów, neutronów i elektronów. Protony niosą dodatni ładunek, podczas gdy neutrony są obojętne. Obie te cząstki tworzą jądro atomowe, które znajduje się w centrum atomu i odpowiada za większość jego masy. Elektrony, posiadając ładunek ujemny, krążą wokół jądra, formując chmurę elektronową. To właśnie równowaga między protonami a elektronami zapewnia neutralność atomu.
Liczba protonów w jądrze, zwana liczbą atomową, definiuje chemiczną tożsamość pierwiastka. Natomiast suma protonów i neutronów określa liczbę masową atomu. Te cząstki są fundamentalne dla zrozumienia chemicznych i fizycznych właściwości pierwiastków. Nukleony, czyli protony i neutrony, odpowiadają za masę atomu, podczas gdy elektrony decydują o jego właściwościach chemicznych.
Zrozumienie struktury atomu umożliwia naukowcom przewidywanie reakcji chemicznych oraz tworzenie nowych technologii. Badania nad atomami pozwalają na projektowanie materiałów o unikalnych cechach i rozwój innowacyjnych rozwiązań w wielu dziedzinach nauki i technologii.
Protony, neutrony i elektrony – podstawowe cząstki atomowe
Protony, neutrony oraz elektrony to fundamentalne składniki atomu. Razem tworzą jego strukturę. Protony, posiadające ładunek dodatni, wraz z obojętnymi neutronami formują jądro atomowe. Jest ono centralną częścią atomu, odpowiedzialną za większość jego masy. Z kolei elektrony, naładowane ujemnie, krążą wokół jądra, tworząc chmurę elektronową na różnych poziomach energetycznych.
Liczba protonów w jądrze, czyli liczba atomowa, determinuje chemiczną tożsamość pierwiastka. Suma protonów i neutronów określa liczbę masową atomu. Te trzy podstawowe cząstki są kluczowe dla zrozumienia chemicznych i fizycznych właściwości pierwiastków oraz ich wzajemnych oddziaływań.
Jądro atomowe – centrum atomu
Jądro atomu, będące jego centralną częścią, składa się z protonów oraz neutronów, które razem określane są mianem nukleonów. Choć jądro zajmuje jedynie niewielką część całego atomu, to właśnie ono odpowiada za większość jego masy. Protony niosą ładunek dodatni, natomiast neutrony są elektrycznie obojętne. Liczba protonów, znana jako liczba atomowa, określa chemiczną tożsamość pierwiastka. Z kolei suma protonów i neutronów, czyli liczba masowa, ma wpływ na fizyczne właściwości atomu. Jądro pełni istotną rolę zarówno w procesach jądrowych, jak i chemicznych.
Modele atomu – od Daltona do Schrödingera
Modele atomu ewoluowały znacząco od czasów Daltona do ery Schrödingera, odzwierciedlając postęp w nauce i technologii. Na początku XIX wieku John Dalton opisał atom jako niepodzielną kulę, co stało się podstawą dla późniejszych teorii.
- w 1897 roku Thomson zaproponował model pudingu z rodzynkami, w którym elektrony były zagłębione w dodatnio naładowanej substancji,
- w 1911 roku Ernest Rutherford zasugerował, że niemal cała masa atomu skupia się w małym, dodatnio naładowanym jądrze, wokół którego krążą elektrony,
- w 1913 roku Niels Bohr rozwinął ten koncept, wprowadzając kwantowe orbity, po których elektrony mogą się przemieszczać bez utraty energii, co przypominało układ planetarny.
Model Schrödingera z lat 20. XX wieku wprowadził zupełnie nowe podejście. Elektrony opisywano funkcją falową, uwzględniając zasady mechaniki kwantowej, co pozwalało lepiej zrozumieć zachowanie cząstek subatomowych. Dzięki funkcji falowej możliwe stało się przewidywanie prawdopodobieństwa znalezienia elektronu w określonym miejscu, co było przełomowe w badaniach nad strukturą atomu. Pozwoliło to na precyzyjniejsze przewidywanie właściwości chemicznych i fizycznych pierwiastków, co ma kluczowe znaczenie dla nauki i technologii.
Model Bohra – atom jako układ planetarny
Model atomu według Bohra to wizja przypominająca układ planetarny, gdzie elektrony krążą w przestrzeni wokół jądra po zdefiniowanych ścieżkach. To obrazowe przedstawienie ułatwiło uchwycenie istoty struktury atomu. Elektrony poruszają się po orbitach kwantowych, nie tracąc przy tym energii, co można porównać do orbitowania planet wokół Słońca. Model ten pozwolił na wyjaśnienie stabilności atomów oraz mechanizmów emisji i absorpcji światła. Chociaż został później zastąpiony przez bardziej zaawansowane teorie kwantowe, jego znaczenie w rozwoju nauki o atomie i jego właściwościach pozostaje nieocenione.
Model Schrödingera – funkcja falowa i zachowanie elektronów
Model Schrödingera wprowadza funkcję falową jako istotny element do opisu zachowania elektronów w atomie. Mechanika kwantowa zakłada, że dzięki tej funkcji można określić prawdopodobieństwo lokalizacji elektronu w określonym miejscu. Elektrony nie krążą po ustalonych orbitach, jak to było w modelu Bohra. Zamiast tego tworzą orbitale atomowe, które przedstawiają chmurę elektronową wokół jądra. Chmura ta pokazuje obszary z różnym prawdopodobieństwem występowania elektronów. W rezultacie można lepiej przewidywać właściwości chemiczne i fizyczne pierwiastków. Model Schrödingera zrewolucjonizował badanie atomów, oferując dokładniejsze narzędzia do analizy ich struktury i zachowań.
Zastosowania atomu w technologii i nauce
Atomy są niezwykle istotne w świecie technologii i nauki, szczególnie w dziedzinach takich jak chemia i fizyka. W chemii stanowią one fundament, decydując o właściwościach pierwiastków oraz ich związków. Z kolei w fizyce atomowej badania nad atomami pozwalają zgłębiać procesy zachodzące na poziomie subatomowym.
Najbardziej widoczne są jednak ich zastosowania w technologii jądrowej. Energia jądrowa, pozyskiwana przez rozszczepienie jąder atomowych, jest wykorzystywana do produkcji prądu w elektrowniach jądrowych, co pozwala na wytwarzanie dużej ilości energii przy minimalnej emisji CO2. Ponadto, technologia ta odgrywa istotną rolę w medycynie, na przykład w radioterapii, która precyzyjnie niszczy komórki nowotworowe, wspomagając terapię raka.
Inne obszary wykorzystania atomów to badania naukowe. Dzięki zaawansowanym technikom, takim jak spektroskopia mas, możliwe jest szczegółowe analizowanie składu chemicznego próbek na poziomie atomowym. Wiedza o właściwościach atomów umożliwia tworzenie innowacyjnych materiałów i technologii, co ma ogromny wpływ na postęp w nauce i technologii.
Rola atomu w chemii i fizyce
Atom pełni istotną funkcję zarówno w chemii, jak i fizyce, będąc kluczowym elementem do zrozumienia chemicznych właściwości substancji oraz mechanizmów reakcji. W chemii atomy definiują cechy pierwiastków oraz ich związki, co umożliwia przewidywanie i analizowanie przebiegu reakcji. W dziedzinie fizyki badania atomowe pozwalają zgłębiać procesy na poziomie subatomowym, co jest niezbędne do rozwijania teorii fizycznych. Struktura atomu, składająca się z protonów, neutronów i elektronów, stanowi podstawę naszego pojmowania materii i jej wzajemnych oddziaływań.
Praktyczne zastosowania technologii jądrowej
Technologia jądrowa znajduje szerokie zastosowanie w różnych dziedzinach, takich jak energetyka, medycyna, przemysł czy badania naukowe. W kontekście energetycznym elektrownie jądrowe wykorzystują reakcje jądrowe do generowania energii elektrycznej. Takie rozwiązanie pozwala na produkcję dużej ilości energii przy minimalnej emisji dwutlenku węgla. Z kolei w medycynie odgrywa kluczową rolę w radioterapii nowotworów, gdzie promieniowanie skutecznie niszczy komórki rakowe.
W przemyśle technologia ta umożliwia precyzyjną kontrolę procesów produkcyjnych oraz analizę materiałów. Promieniotwórczość stosuje się tam m.in. do pomiaru grubości i gęstości, co jest istotne dla zapewnienia wysokiej jakości produktów. W dziedzinie nauki, zaawansowane metody, takie jak spektroskopia mas, pozwalają na szczegółową analizę chemiczną na poziomie atomowym, co przyczynia się do rozwoju nowych materiałów i technologii.
Dzięki przemianom promieniotwórczym i reakcjom jądrowym, technologia jądrowa wspiera postęp naukowo-techniczny, wpływając na nowoczesne innowacje i polepszając jakość życia.